
En el documento se recogen los principales indicadores que permiten conocer la actividad de la Agencia, así como los proyectos y avances más destacados. En 2016 la AEMPS puso en marcha la Oficina de Apoyo a la Innovación y Conocimiento sobre medicamentos con el fin de integrar, coordinar y potenciar ...
En el documento se recogen los principales indicadores que permiten conocer la actividad de la Agencia, así como los proyectos y avances más destacados. En 2016 la AEMPS puso en marcha la Oficina de Apoyo a la Innovación y Conocimiento sobre medicamentos con el fin de integrar, coordinar y potenciar las distintas actividades e iniciativas realizadas en apoyo a la investigación y desarrollo de nuevos medicamentos.
Durante 2016 se publicaron 55 informes de posicionamiento terapéutico después de la decisión de precio/ financiación de la Dirección General de Cartera Básica del Sistema Nacional de Salud y Farmacia.También durante este año se han reforzado las garantías de abastecimiento del mercado de los medicamentos ya autorizados. Los problemas de disponibilidad de medicamentos tienen múltiples causas pero una única consecuencia: la ausencia de un medicamento para un paciente que lo necesita.
En 2016 el Parlamento y Consejo Europeo aprobaron los nuevos Reglamentos de productos sanitarios y de productos sanitarios para diagnóstico in vitro que modifican cuestiones tan relevantes como el procedimiento de evaluación de los productos y la configuración y funcionamiento de los organismos notificados.
Medicamentos de uso humano
Junto con la innovación, el apoyo a la investigación es una de las prioridades de la AEMPS. En diciembre del año 2016 se puso en marcha la Oficina de Apoyo a la Innovación y Conocimiento sobre Medicamentos y entró en vigor el Real decreto 1090/2015 de 4 diciembre que regula los ensayos clínicos adaptando la legislación española a las previsiones del Reglamento europeo en los aspectos nacionales con el objetivo de ganar competencia y atraer la investigación a nuestro país a la vez que se garantiza la seguridad de los pacientes sujetos del ensayo. Dicho Real decreto tendrá su pleno desarrollo en 2017 y 2018 en relación con la aplicación del Reglamento 536/2014 del Parlamento Europeo.
La AEMPS autorizó el año pasado 791 ensayos clínicos con medicamentos de uso humano
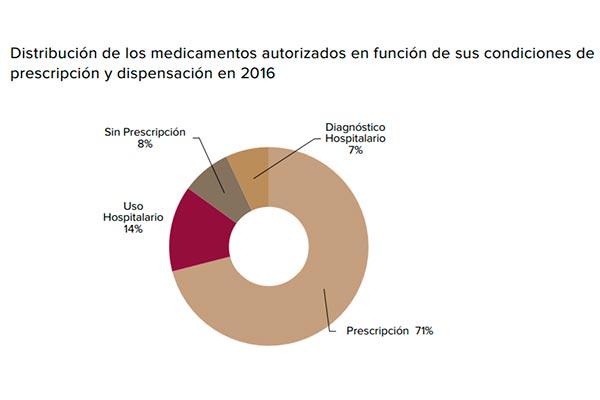
Al finalizar el año 2016 había en España más de 16.800 medicamentos autorizados con cerca de 29.300 presentaciones o formatos, de los cuales 1.203 fueron autorizados en el año 2016 por la AEMPS. Por tipo de medicamento, 811 (67%) se corresponden con medicamentos genéricos. En 2016, se recibieron y analizaron 20.071 notificaciones de sospechas de reacción adversa en el Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano.
Otra de las actividades importantes es la liberación individualizada de lotes de vacunas, mezclas de plasma y hemoderivados que requieren de una autorización previa por parte de la AEMPS antes de su puesta en el mercado. En total en 2016 se analizaron un total de 602 muestras de mezclas de plasma y 680 muestras de hemoderivados que han resultado en la emisión de 1.282 certificados europeos de liberación de lote. En cuanto a la liberación documental, se liberaron 923 lotes de hemoderivados y 385 lotes de vacunas.
Medicamentos veterinarios
En 2016 se autorizaron 38 ensayos clínicos con medicamentos veterinarios y 16 Productos en Investigación Clínica. La AEMPS autorizó la comercialización en el año 2016 de 150 medicamentos veterinarios (16% más que el año anterior), siendo su inmensa mayoría (86%) por procedimientos europeos, lo que supone un gran avance para la industria nacional que busca internacionalizar el sector.
Plan estratégico y de acción para reducir el riesgo de selección y diseminación de resistencias a los antibióticos 2014-2018
Otro aspecto de gran trascendencia a nivel mundial, y al que la AEMPS viene dedicando un esfuerzo muy importante en los últimos años, es la lucha frente a las resistencias a los antibióticos, actuaciones realizadas en el marco del Plan estratégico coordinado por la AEMPS, en coordinación con las diferentes direcciones generales de la Secretaría General de Sanidad y Consumo y la AECOSAN.
Inspección y control de medicamentos
En la actualidad existen en España 273 laboratorios fabricantes/importadores de medicamentos con un total de 512 plantas autorizadas en España para fabricar, importar y/o almacenar medicamentos. Además, hay registradas 218 empresas fabricantes, importadoras o distribuidoras de principios activos. Respecto a las inspecciones cabe destacar el incremento habido en las inspecciones internacionales de normas de correcta fabricación a la industria, realizándose 51 inspecciones en 2016, lo que supone un incremento notable con respecto al año anterior. La AEMPS continuó en 2016 con las investigaciones y actuaciones contra la venta ilegal de medicamentos a través de Internet, año durante el cual se investigaron un total de 993 páginas web (incremento del 176% con respecto al año anterior).
Productos sanitarios
En 2016 el Parlamento y Consejo Europeo aprobaron los nuevos Reglamentos de productos sanitarios y de productos sanitarios para diagnóstico in vitro que van a suponer uno de los mayores cambios a enfrentar ya que se modifica, entre otros aspectos, el procedimiento de evaluación de los productos y la configuración y funcionamiento de los organismos notificados entre los que se encuentra el Organismo Notificado Europeo 0318 dependiente del Ministerio de Sanidad, Servicios Sociales e Igualdad.
Productos cosméticos y de cuidado personal
Durante 2016, con base en el régimen de declaración responsable de actividades de fabricación e importación, se recibieron un total de 399 declaraciones. En cuanto a la emisión de los certificados de Buenas Prácticas de Fabricación de cosméticos, esenciales como apoyo a las empresas exportadoras, durante 2016 se emitieron un total de 20 certificados.
En 2016 se recibieron 52 notificaciones de efectos no deseados de cosméticos. En cuanto a las actividades de control de mercado se han evaluado 809 casos. Asimismo, en el seno del Grupo de Cosméticos del Comité Técnico de Inspección, se realizó un programa nacional sobre perfumes que se envasan en el punto de venta a petición del consumidor.