España financia el 71% de fármacos aprobados por la EMA, según un informe
Un informe elaborado por la IQVIA para la Efpia ha revelado este dato que evidencia la mejora en el acceso de los pacientes a los nuevos medicamentos en España . No obstante, desde Farmaindustria valoran que aún es necesario un marco normativo con la capacidad de fomentar la innovación, fortalecer la autonomía estratégica de Europa y garantizar una accesibilidad rápida y equitativa.

Estado: Esperando
España avanza en la disponibilidad de medicamentos innovadores dentro de su sistema sanitario y ya financia el 71% de los fármacos que aprueba la Agencia Europea de Medicamentos (EMA). Así lo revela el informe Indicadores de acceso a terapias innovadoras en Europa 2024 (W.A.I.T Indicator), elaborado por la consultora Iqvia ...
España avanza en la disponibilidad de medicamentos innovadores dentro de su sistema sanitario y ya financia el 71% de los fármacos que aprueba la Agencia Europea de Medicamentos (EMA). Así lo revela el informe Indicadores de acceso a terapias innovadoras en Europa 2024 (W.A.I.T Indicator), elaborado por la consultora Iqvia para la Federación Europea de la Industria Farmacéutica (Efpia) y publicado este miércoles, que señala que, de los 173 medicamentos autorizados en la UE entre 2020 y 2023, España tiene financiados 123 (a fecha de enero de 2025).
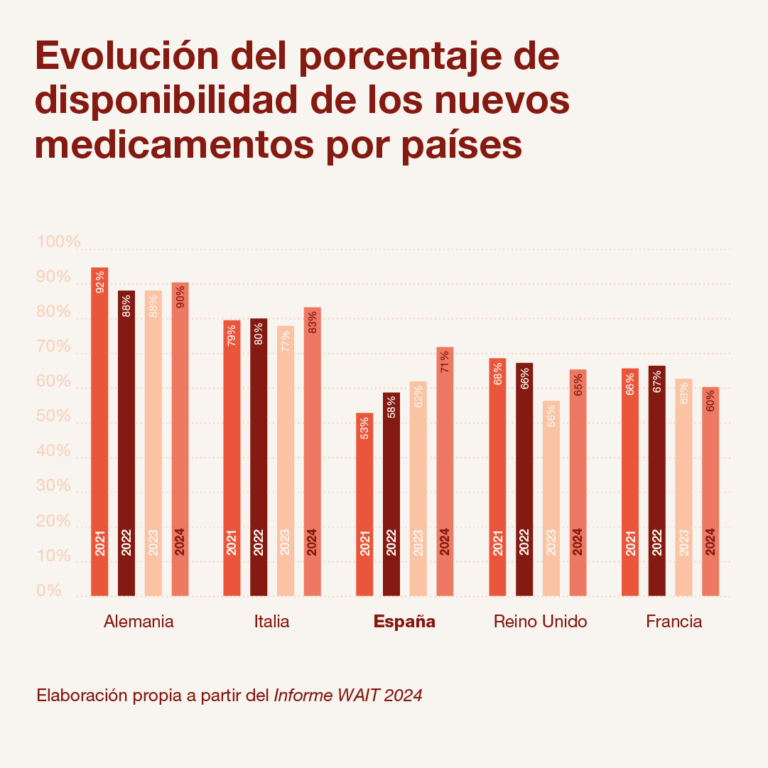
Esta cifra de disponibilidad de nuevos medicamentos es la más alta de los últimos años y confirma una tendencia positiva en la mejora de este indicador. De hecho, España es, junto con Italia, uno de los grandes países europeos que ha mejorado esta ratio —casi 20 puntos en los cuatro últimos años—, mientras que otros, como Reino Unido o Francia, ya caen a posiciones por debajo de nuestro país.
No obstante, como recuerda el director general de Farmaindustria, Juan Yermo, "España no cuenta aún con un sistema de financiación claro y predecible para consolidar esta senda". "Necesitamos un marco normativo estable que fomente la innovación, fortalezca la autonomía estratégica de Europa y garantice un acceso rápido y equitativo a los medicamentos innovadores en España", añade.
La publicación de este informe coincide con la tramitación del Anteproyecto de Ley de los Medicamentos y Productos Sanitarios, que, junto con el posterior Real Decreto de Precio y Financiación, debería establecer las bases de cuál será el modelo de acceso a la innovación que quiere España para los próximos años, en un contexto de revolución biomédica, claramente impactada por el uso de la ciencia de los datos y la inteligencia artificial. A lo anterior también se añade el Real Decreto de Evaluación de Tecnologías, en fase de tramitación, en el que se regula cómo se realizará la evaluación de los medicamentos como paso previo a la toma de decisión de financiación.
Asimismo, la futura Ley debería responder a los objetivos de la Estrategia de la Industria Farmacéutica 2024-2028, la única para un sector industrial en nuestro país y que supone un reconocimiento a su valor fundamental en el ámbito sanitario, económico y social. "Tenemos ante nosotros una oportunidad única en estos desarrollos normativos, como la futura Ley de los Medicamentos, para transformar nuestra sanidad y prepararla para los próximos 20 años. Y no podemos perderla", reclama Yermo.
En este sentido, Farmaindustria ha propuesto una serie de mejoras en el procedimiento de fijación de precios y financiación pública de medicamentos, con el objetivo de establecer un modelo ágil, predecible, eficiente y sostenible, que haga del mercado español un entorno atractivo para las compañías farmacéuticas. "España ya es líder europeo y uno de los líderes mundiales en el desarrollo de ensayos clínicos. Sabemos muy bien qué significa que un paciente con una enfermedad grave pueda tener a su alcance una opción, una esperanza, en medio de la dificultad. Por lo tanto, el Ministerio de Sanidad tiene ante sí la ocasión de crear las condiciones para convertirnos también en un país líder en acceso a los nuevos medicamentos. Y para ello cuenta con toda la colaboración y apoyo de la industria farmacéutica", asevera el director general de Farmaindustria.

Una espera que mejora, pero sigue siendo demasiado larga
Con la mirada de nuevo puesta en el `Informe WAIT 2024', sigue siendo aún demasiado extenso el tiempo que un paciente espera en España para acceder a un medicamento innovador: 616 días de media, unos 20 meses. Aunque mejora con respecto a 2023 en casi 50 días, este plazo sobrepasa ampliamente los 180 días establecidos por la Directiva europea que regula la fijación de precios de los medicamentos y su inclusión en el ámbito de los sistemas nacionales de salud.
Si en lugar de tener en cuenta la fecha de la autorización europea (la que usa el `Informe WAIT' para permitir la comparación entre países) se contabiliza desde el momento en el que la compañía manifiesta su interés en comercializar en España (obtención del Código Nacional), el tiempo se reduce hasta los 579 días, una espera que también supera con creces los 180 días fijados en la legislación europea. De hecho, las compañías farmacéuticas tardan una media de 112 días para hacer la solicitud de comercialización, un tiempo que en el caso de las compañías asociadas a Farmaindustria se reduce a los 67 días.
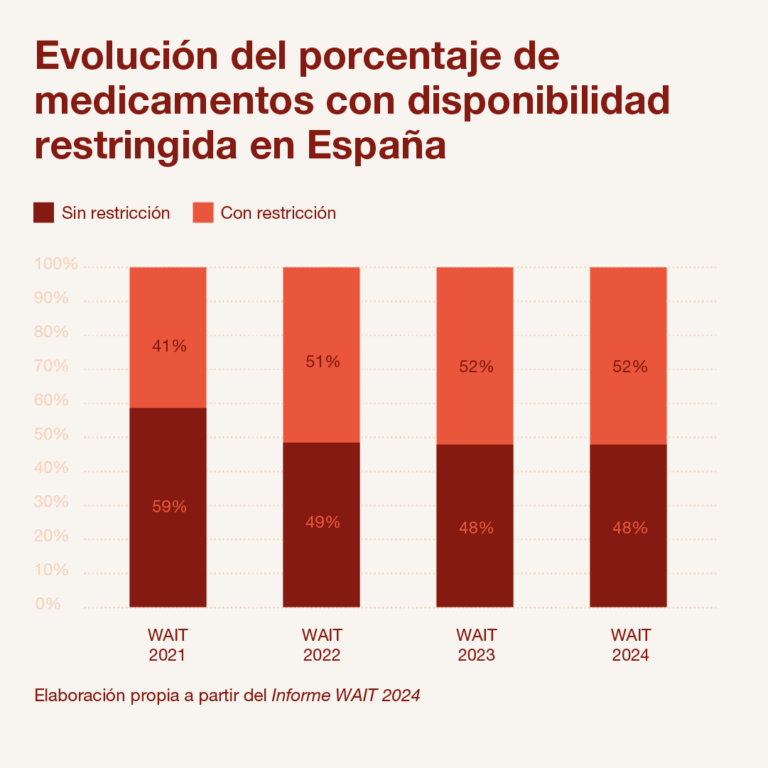
Uno de cada dos medicamentos financiados tiene un acceso restringido
Por otro lado, como se aprecia en el informe de Iqvia, más de la mitad de los nuevos medicamentos disponibles en nuestro país (52%) cuentan con una disponibilidad limitada. Es decir, que 64 de los 123 medicamentos financiados en España en el periodo analizado (2021-2024) están sometidos a algún tipo de restricción de uso, por indicación terapéutica, tipo de paciente, etc. El porcentaje de medicamentos con restricciones en España sigue muy por encima de otros países de la UE como Alemania (1%), Italia (9%) o Países Bajos, que no aplica restricciones de uso a los nuevos medicamentos financiados frente a las indicaciones aprobadas por la EMA.
"Los medicamentos innovadores se desarrollan para transformar la vida de las personas que padecen una enfermedad y que, en muchos casos, llevan tiempo conviviendo con ella sin una opción terapéutica que pueda curarles o, al menos, mejorar su calidad de vida. Financiar un medicamento con restricciones con respecto a la indicación terapéutica autorizada en ficha técnica por Europa puede dejar fuera a muchos pacientes", subraya la directora de Prestación Farmacéutica y Acceso de Farmaindustria, Isabel Pineros. En su lugar, propone, se pueden "promover acuerdos con las compañías farmacéuticas que permitan utilizar los medicamentos sin restricción alguna, pero evaluando cómo funcionan en vida real y ajustando los posibles riesgos económicos".
En la actualidad, en España no existe un procedimiento de financiación acelerada para grupos de pacientes donde el beneficio es más relevante —por gravedad o en caso de enfermedades sin alternativa terapéutica—, como en otros países, ni la posibilidad de acortar el tiempo de disponibilidad de una manera predecible. La única opción de los pacientes para acceder a medicamentos disruptivos es mediante solicitud individualizada, como fija el Real Decreto por el que se regula la disponibilidad de medicamentos en situaciones especiales. Sin embargo, no se publican datos que permitan medir este acceso.
Con el objetivo de acelerar la llegada de los medicamentos de forma acelerada, Farmaindustria plantea un procedimiento que permita una decisión de financiación acelerada para los fármacos que cumplan ciertos criterios que hagan más urgente su financiación en un plazo máximo de 90 días. "Necesitamos garantizar que todos los pacientes reciban en condiciones de equidad el mejor tratamiento posible, y en ocasiones eso no es posible con la dinámica actual. Proponemos que se establezcan criterios y un sistema claro y predecible que mejore la disponibilidad de los nuevos tratamientos cuando más se necesitan", afirma Pineros.




